二氧化硫
 分子球狀模型
分子球狀模型二氧化硫又稱亞硫酸酐,是最常見的硫氧化物,為硫酸原料氣的主要成分,是大氣主要污染物之一。無色氣體,有強烈刺激性氣味。火山爆發時會噴出該氣體,在許多工業過程中也會產生二氧化硫。由于煤和石油通常都含有硫化合物,因此燃燒時會生成二氧化硫。當二氧化硫溶于水中,會形成亞硫酸(酸雨的主要成分)。若把SO2進一步氧化,通常在催化劑如二氧化氮的存在下,便會生成硫酸。
 二氧化硫的三種共振結構,中央的共振結構對混成體之貢獻最大
二氧化硫的三種共振結構,中央的共振結構對混成體之貢獻最大
二氧化硫,是一個彎曲的分子,其對稱點群為C2v。硫原子的氧化態為+4,形式電荷為0,被5個電子對包圍著,因此可以描述為超價分子。從分子軌道理論的觀點來看,可以認為這些價電子大部分都參與形成S-O鍵。
SO2中的S-O鍵長(143.1 pm)要比一氧化硫中的S-O鍵長(148.1 pm)短,而O3中的O-O鍵長(127.8 pm)則比氧氣O2中的O-O鍵長(120.7 pm)長。SO2的平均鍵能(548 kJ mol?1)要大于SO的平均鍵能(524 kJ mol?1),而O3的平均鍵能(297 kJ mol?1)則小于O2的平均鍵能(490 kJ mol?1)。這些證據使化學家得出結論:二氧化硫中的S-O鍵的鍵級至少為2,與臭氧中的O-O鍵不同,臭氧中的O-O鍵的鍵級為1.5。
分子結構與極性:V形分子,極性分子。
二氧化硫是無色有刺激性氣味的氣體。溶于丙酮、乙醇、甲酸等多種有機溶劑,溶于水(0℃時溶解度22.8g/l00ml,90℃時溶解度0.58g/100ml)。水溶液呈酸性。在硫酸溶液中的溶解度以硫酸濃度為85%時為最小。液態時為良好的溶劑。2000℃以上發生熱分解,也可通過電場放電、紫外線或X射線輻射等分解。
酸性氧化物
SO2是酸性氧化物,具有酸性氧化物的通性。可以與水作用得到二氧化硫水溶液,即“亞硫酸”(中強酸),但真正的亞硫酸分子從未在溶液中觀測到。
S02+H2O<——>H2SO3
與堿反應形成亞硫酸鹽和亞硫酸氫鹽。以與氫氧化鈉的反應為例,產物是 Na2SO3 還是 NaHSO3,取決于二者的用量關系。
SO2+2NaOH——>Na2SO3+H2O或
SO2+NaOH——>Na2SO3
與堿性氧化物反應生成鹽。
氧化還原反應
SO2中的硫元素的化合價為+4價,為中間價態,既可升高,也可下降。所以SO2既有氧化性,又有還原性,但以還原性為主。
SO2的還原性較強,可被多種氧化劑(如 O2、Cl2、Br2、HNO3、KMnO4等)氧化。
SO2+CL2——>SO2CL2
2SO2+O2<——>2SO3(該反應為可逆反應,條件為加熱和催化劑:V2O5 / Pt / Cr2O3)
SO2也有一定的氧化性,如:
SO2+2H2S——>3S+2H2O
工業上可以用此反應制造高純度硫磺。
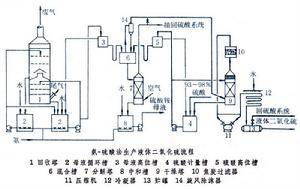
工業制備
 二氧化硫
二氧化硫
制取二氧化硫的方法有:焚燒硫磺;焙燒硫鐵礦或有色金屬硫化礦;焚燒含硫化氫的氣體;煅燒石膏或磷石膏;加熱分解廢硫酸或硫酸亞鐵;以及從燃燒含硫燃料的煙道氣中回收(見硫酸原料氣)。
生產液體二氧化硫時通常先制得純二氧化硫氣體,然后經壓縮或冷凍將其液化。重要的工業生產方法有:
①哈涅希-希洛特法。此法始創于1884年,以水作吸收劑,吸收二氧化硫后的溶液以蒸汽解吸,解吸氣經冷凝、干燥后液化。現在發展了加壓水吸收法。
②氨-硫酸法。此法常用于一次轉化的接觸法硫酸廠中尾氣二氧化硫的回收 。以氨水為原始吸收劑,用硫酸分解吸收液,制得純二氧化硫氣體。
③溶液吸收法。以無機或有機溶液吸收低濃度二氧化硫氣體,然后將吸收液加熱再生,制得純二氧化硫。主要的吸收劑有碳酸鈉、檸檬酸鈉、堿式硫酸鋁、有機胺類等的溶液。
④直接冷凝法。以冷凍法從含二氧化硫的氣體中將其部分冷凝分離,直接制得液體二氧化硫,未冷凝的二氧化硫返回硫酸生產系統。
⑤三氧化硫-硫磺法。使液體硫磺與三氧化硫在反應器中進行反應,制得純二氧化硫氣體。
實驗室制備
實驗室通常用亞硫酸鈉與濃硫酸反應制取二氧化硫
Na2SO3+H2SO4=Na2SO4+SO2(g)+H2O
或用銅與濃硫酸加熱反應
Cu+2H2SO4=△=CuSO4+SO2(g)+2H2O
尾氣處理:通入氫氧化鈉溶液
2NaOH+SO2=Na2SO3+H2O
其它方法
二氧化硫可以在硫磺燃燒的條件下生成
S(s)+O2(g) → SO2(g)
硫化氫可以燃燒生成二氧化硫
2H2S(g) +3O2(g) → 2H2O(g) +2SO2(g)
加熱硫鐵礦,閃鋅礦,硫化汞,可以生成二氧化硫
4FeS2(s) +11O2(g) → 2Fe2O3(s) +8SO2(g)
2ZnS(s) +3O2(g) → 2ZnO(s) +2SO2(g)
HgS(s) +O2(g) → Hg(g) +SO2(g)
二氧化硫除了主要用于生產硫酸外,其他重要用途有:在造紙工業中生產亞硫酸鹽紙漿;制造各種亞硫酸鹽、亞硫酸氫鹽、硫代硫酸鹽;生產錦綸(尼龍6)單體、合成洗滌劑、橡膠促進劑等有機化合物;也用于醫藥工業。二氧化硫還可作為織物和皮革的漂白劑;農業上用作熏蒸消毒劑;食品工業中用作防腐和消毒劑。液態二氧化硫是一些有機物的良好溶劑,用于礦物油類的精制。
二氧化硫對食品有漂白和防腐作用,使用二氧化硫能夠達到使產品外觀光亮、潔白的效果,是食品加工中常用的漂白劑和防腐劑,但必須嚴格按照國家有關范圍和標準使用,否則,會影響人體健康。
防腐劑
由于二氧化硫的抗菌性質,它有時用作干杏和其它干果的防腐劑,用來保持水果的外表,并防止腐爛。二氧化硫的存在,可以使水果有一種特殊的化學味道。
釀酒
二氧化硫是釀酒時非常有用的化合物,它的E編碼為E220。它甚至在所謂的“無硫的”酒中也存在,濃度可達每升10毫克。它作為抗生素和抗氧化劑,防止酒遭到細菌的損壞和氧化。它也幫助把揮發性酸度保持在想要的程度。酒的標簽上之所以有“含有亞硫酸鹽”等字句,就是因為二氧化硫。根據美國和歐盟的法律,如果酒的SO2濃度低于10ppm,則不需要標示“含有亞硫酸鹽”。酒中允許的SO2濃度的上限在美國為350ppm,而在歐盟,紅酒為160ppm,白酒為210ppm。如果SO2的濃度很低,那么便很難探測到,但當濃度大于50ppm時,用鼻子就能聞出SO2的氣味,用舌頭也能品嘗出來。
SO2還是釀酒廠衛生的很重要的要素。釀酒廠和設備必須保持十分清潔,且因為漂白劑不能用于釀酒廠中,SO2、水和檸檬酸的混合物通常用來清潔水管、水槽和其它設備,以保持清潔和沒有細菌 。
還原性漂白劑
 還原性原理
還原性原理
二氧化硫還是一個很好的還原劑。在水的存在下,二氧化硫可以使物質褪色。特別地,它是紙張和衣物的有用的漂白劑。這個漂白作用通常不能持續很久。空氣中的氧氣把被還原的染料重新氧化,使顏色恢復。
可以下列化學方程式表示: H2SO3 + 染料 → H2SO4 + (染料 - O )
因為空氣提供氧氣給予染料,染料被馬上氧化,顯示原來的顏色,這就是漂白作用通常不能持續很久的原因。可以下列化學方程式表示: 2 (染料 - O ) + O2 → 2染料
中學實驗室中用堿性品紅溶液檢測二氧化硫的存在。二氧化硫可以使品紅試液褪色,從而說明二氧化硫使有機物漂白的性質;而褪色后的溶液經過加熱,又恢復為紅色,從而說明了二氧化硫漂白的原理是與有機物生成了“加合物”,而此類加合物不穩定,加熱時便分解,又放出二氧化硫。一個相關的化學鑒定方法稱為Schiff法,是用亞硫酸氫鈉與品紅或副品紅發生加成,再用二氧化硫脫色。如果得到的溶液(Schiff試劑)與待檢試液作用生成粉紅色或紫色,則可以證明待檢試液中醛類的存在 。
硫酸的前體
二氧化硫還用來制備硫酸,首先轉化成三氧化硫,然后再轉化成發煙硫酸,最后轉化成硫酸。這個過程中的二氧化硫是含硫礦物與氧氣反應產生的。把二氧化硫轉化成硫酸的過程,稱為接觸法。
制冷劑
由于二氧化硫容易液化,且汽化熱很大,因此適合作為制冷劑。在氟利昂的發展之前,二氧化硫就曾經用作家用冰箱的制冷劑。
試劑和溶劑
液態二氧化硫是萬用的惰性溶劑,廣泛用于溶解強氧化性鹽。它會發生自偶電離生成SO2+ 和SO32- 。
2SO2——>SO2+ +SO32-
它有時也用作有機合成中磺酰基的來源,把芳基重氮鹽用二氧化硫處理,便可獲得對應的芳基磺酰氯。
脫氯
在城市的污水處理中,二氧化硫用來處理排放前的氯化污水。二氧化硫與氯氣反應,氯氣被還原,生成Cl- 。
危險性
危險性類別:三星級
健康危害: 易被濕潤的粘膜表面吸收生成亞硫酸、硫酸。對眼及呼吸道粘膜有強烈的刺激作用。大量吸入可引起肺水腫、喉水腫、聲帶痙攣而致窒息。急性中毒:輕度中毒時,發生流淚、畏光、咳嗽,咽、喉灼痛等;嚴重中毒可在數小時內發生肺水腫;極高濃度吸入可引起反射性聲門痙攣而致窒息。皮膚或眼接觸發生炎癥或灼傷。慢性影響:長期低濃度接觸,可有頭痛、頭昏、乏力等全身癥狀以及慢性鼻炎、咽喉炎、支氣管炎、嗅覺及味覺減退等。少數工人有牙齒酸蝕癥 。
燃爆危險: 本品不燃,有毒,具強刺激性。
急救措施
皮膚接觸: 立即脫去污染的衣著,用大量流動清水沖洗。就醫。
眼睛接觸: 提起眼瞼,用流動清水或生理鹽水沖洗。就醫。
吸入: 迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
消防措施
危險特性: 不燃。若遇高熱,容器內壓增大,有開裂和爆炸的危險。
有害燃燒產物: 氧化硫。
滅火方法: 本品不燃。消防人員必須佩戴過濾式防毒面具(全面罩)或隔離式呼吸器、穿全身防火防毒服,在上風向滅火。切斷氣源。噴水冷卻容器,可能的話將容器從火場移至空曠處。
滅火劑:霧狀水、泡沫、二氧化碳。
泄漏應急處理
應急處理: 迅速撤離泄漏污染區人員至上風處,并立即進行隔離,小泄漏時隔離150m,大泄漏時隔離450m,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。從上風處進入現場。盡可能切斷泄漏源。用工業覆蓋層或吸附/ 吸收劑蓋住泄漏點附近的下水道等地方,防止氣體進入。合理通風,加速擴散。噴霧狀水稀釋、溶解。構筑圍堤或挖坑收容產生的大量廢水。如有可能,用一捉捕器使氣體通過次氯酸鈉溶液。漏氣容器要妥善處理,修復、檢驗后再用。
操作處置與儲存
操作注意事項: 嚴加密閉,提供充分的局部排風和全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防毒面具(全面罩),穿聚乙烯防毒服,戴橡膠手套。遠離易燃、可燃物。防止氣體泄漏到工作場所空氣中。避免與氧化劑、還原劑接觸。搬運時輕裝輕卸,防止鋼瓶及附件破損。配備泄漏應急處理設備。
儲存注意事項: 儲存于陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與易(可)燃物、氧化劑、還原劑、食用化學品分開存放,切忌混儲。儲區應備有泄漏應急處理設備。
2012年5月21日,香港特區政府食物安全中心公布肉類添加二氧化硫調查的第一期檢測結果。調查顯示,172個鮮肉樣本中,共有13個樣本檢出含有不可在新鮮、冰鮮及冷藏肉類中使用的防腐劑二氧化硫。個別販商為使肉類的色澤更鮮明,在肉類中添加二氧化硫。
2012年6月,湖南省工商局召開新聞發布會,公布了二季度流通環節食品抽檢情況。其中花椒、辣椒制品和火鍋底料的抽檢結果合格率不到7成,問題主要是違法添加羅丹明B和二氧化硫殘留量超標。羅丹明B是一種致癌性的人工合成染料,二氧化硫則用于漂白和防腐。
2012年6月20日,北京市食品辦公布了不合格下架食品名單,美廉美超市銷售的一款黃花菜被檢出二氧化硫超標。此次共檢出9個不合格樣本,其中8個為二氧化硫超標,其殘留量是標準值的兩倍多。北京景海德實便利店銷售的標稱北京錦繡大地物流港管理有限責任公司調料C區207-208號生產的散裝枸杞,二氧化硫實測值為標準值的46倍。如食品中的二氧化硫嚴重超標,人食用后會出現惡心、嘔吐等現象,還會影響鈣吸收。
